Médicaments biosimilaires
Les médicaments biosimilaires, qu'est-ce que c'est ?
Selon l’ANSM, « un médicament biosimilaire est similaire à un médicament biologique (substance qui est produite à partir d’une cellule ou d’un organisme vivant ou dérivée de ceux-ci) de référence qui a déjà été autorisé en Europe. Le principe de biosimilarité s’applique à tout médicament biologique dont le brevet est tombé dans le domaine public. Les médicaments biosimilaires sont évalués à l’Agence européenne des médicaments (EMA) ».
L’expiration des brevets des biomédicaments de référence a ouvert la possibilité de produire et de commercialiser des médicaments biosimilaires à ces derniers.
Pour obtenir son Autorisation de Mise sur le Marché (AMM), un médicament biosimilaire a fait la preuve de sa similarité biologique et clinique (qualité, sécurité, efficacité) avec le médicament de référence.
L’ANSM met à jour régulièrement une liste de références des groupes biologiques similaires présentée par DCI de la substance : pour accéder à cette liste, cliquez ici.
L’arrivée de ces médicaments biosimilaires sur le marché représente un véritable enjeu de maîtrise des dépenses de santé pour maintenir un niveau élevé d’accès des patients à des traitements innovants.
L’instruction du 3 août 2017 rappelle la définition des médicaments biosimilaires et clarifie le cadre législatif applicable à leur prescription.
Elle précise notamment les points suivants :
- Un médicament biosimilaire peut être prescrit à tout moment du traitement (en initiation de traitement ou en switch)
- La prescription d’un médicament biosimilaire induit la même obligation d’information du patient ou de traçabilité que les médicaments biologiques de référence, mais aucune obligation supplémentaire
Documents utiles :
- Liste ANSM : Médicaments biosimilaires de référence
- Liste des médicaments biosimilaires - Assurance Maladie
- Outils de l'Assurance Maladie - A destination des professionnels de santé : Prescription des biosimilaires
- Rapport ANSM - Actualisé en février 2022 : Etat des lieux des biosimilaires
Substitution des biosimilaires
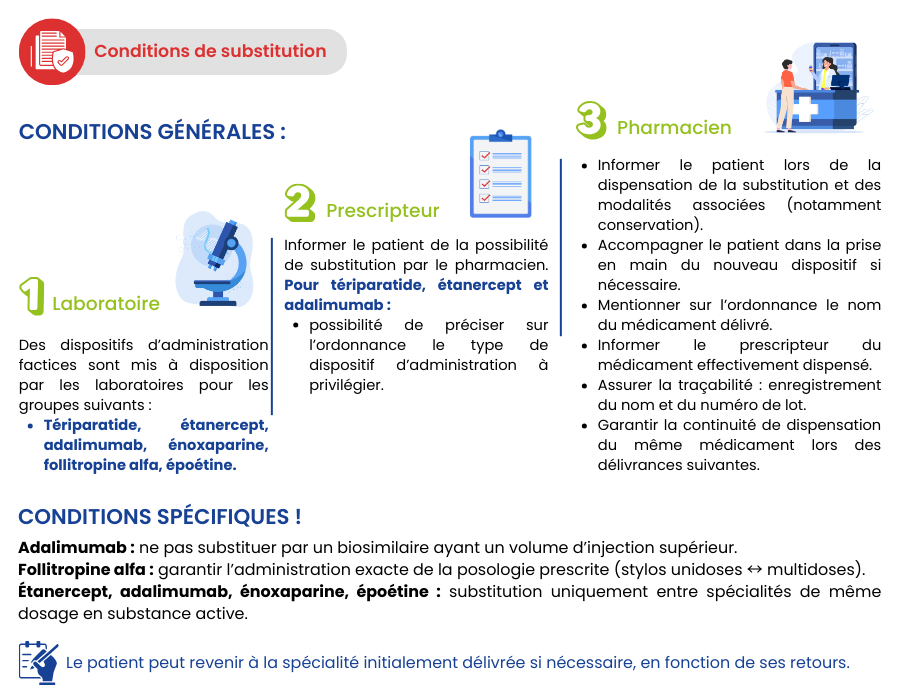
L’arrêté du 4 février 2026 (JO du 6 février 2026), modifiant l’arrêté du 20 février 2025 (JO du 27 février 2025), fixe la liste des groupes biologiques similaires substituables par le pharmacien d’officine ainsi que les conditions de substitution et d’information du prescripteur et du patient, telles que prévues au 2° de l’article L. 5125-23-2 du Code de la Santé Publique. Ces arrêtés abrogent l’arrêté du 12 avril 2022 (JO du 14 avril 2022) et l’arrêté du 31 octobre 2024 (JO du 3 novembre 2024).
Cet arrêté étend la liste des groupes biosimilaires pouvant donner lieu à une délivrance par substitution au médicament biologique de référence et modifie les conditions de substitution et d'information du prescripteur et du patient.
Aussi, à ce jour, la substitution par le pharmacien d’officine ne concerne que les médicaments disponibles en ville et est autorisée pour les groupes biologiques similaires suivants :
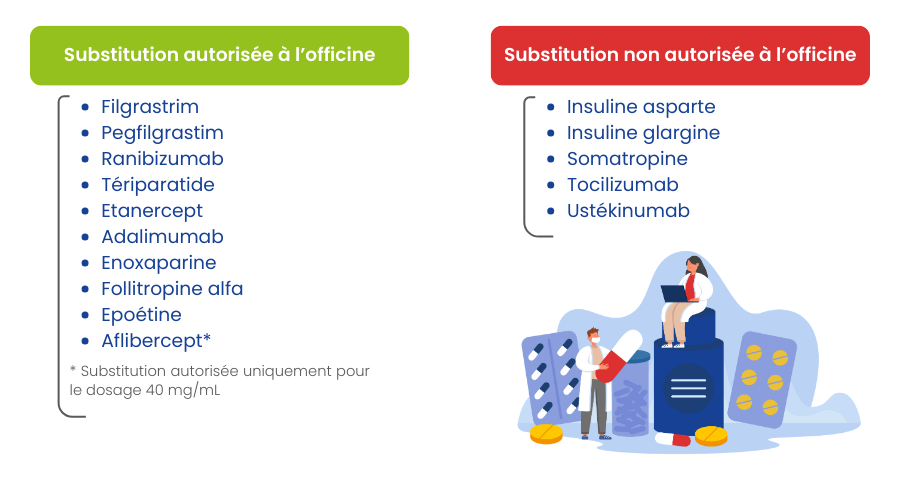
*Il est à noter que la substitution de l’aflibercept n’est autorisée que pour le dosage de 40mg/mL. Les spécialités EYLEA® 114,3 mg/mL (solution injectable et solution injectable en seringue préremplie) ne disposent pas de médicament biosimilaire associé.
Il est également à noter que l’ANSM a rendu un avis favorable à la substitution de l’ustékinumab (avis de l’ANSM en date du 04/02/2026), mais celle-ci n’est pas autorisée à ce jour en l’absence de publication par arrêté ministériel.
Vous trouverez le lien vers la fiche BIOSIMILAIRE : FOCUS SUBSTITUTION EN OFFICINE (OMEDIT IDF)
 L’Assurance Maladie met également à disposition un outil interactif de visualisation de la consommation des biosimilaires en France et dans les établissements de santé - VisuBiosim.
L’Assurance Maladie met également à disposition un outil interactif de visualisation de la consommation des biosimilaires en France et dans les établissements de santé - VisuBiosim.
Substitution ou interchangeabilité : Quelles différences ?
L’ANSM définit ces deux notions de la manière suivante :
- Interchangeabilité : Le prescripteur peut remplacer un médicament par un autre médicament censé avoir le même effet clinique. Il peut s’agir de remplacer un médicament de référence par un médicament biosimilaire ou inversement, ou de remplacer un biosimilaire par un autre biosimilaire avec le même objectif thérapeutique.
- Substitution : Acte pharmaceutique par lequel le pharmacien peut remplacer un médicament par un autre médicament interchangeable, sans en référer au prescripteur, sauf opposition expresse de celui-ci et dans les conditions strictes définies par l'arrêté ministériel en vigueur, notamment l'arrêté du 4 février 2026.
Ainsi l’acte d’interchangeabilité est un acte médical tandis que la substitution est un acte pharmaceutique. Dans les deux cas, ces actions peuvent intervenir au début du traitement ou en cours de traitement.
Il est à noter que dans le cas des médicaments biosimilaires, si le patient refuse la substitution le tiers payant reste applicable.
Médicaments génériques
Les médicaments génériques, qu'est-ce que c'est ?
Un médicament générique est conçu à partir de la molécule d’un médicament déjà commercialisé. Ce médicament appelé « médicament d’origine » a été mis sur le marché après environ 10 ans d’études scientifiques. Puis, le brevet est tombé dans le domaine public. C'est-à-dire que les autres laboratoires pourront désormais demander des autorisations de mise sur le marché pour leur médicament générique issu de la même molécule.
Un médicament générique est donc un médicament bien connu avant même sa commercialisation grâce à l’expérience accumulée, par le médicament d’origine, en termes d’efficacité et de sécurité d’emploi de sa molécule. Comme tout médicament, le médicament générique est ensuite contrôlé à toutes les étapes de sa fabrication. C’est un médicament auquel on peut faire confiance.
Un médicament générique peut différer en taille, en forme, en couleur ou en goût du médicament d’origine mais cela ne modifie ni son efficacité, ni sa sécurité d’emploi. Les médicaments génériques font des économies sur les frais de recherche et développement déjà amortis par les médicaments d’origine. De plus, ils ont généralement moins de frais marketing et publicitaires. Ils peuvent donc proposer un prix de vente inférieur, tout en garantissant une qualité équivalente.
Le médecin fait le choix d’un mécanisme d’action, donc d’une molécule qui correspond aux besoins médicaux et à la situation personnelle du patient. Cette molécule porte un nom : la dénomination commune internationale (DCI). C’est le vrai nom scientifique du médicament, que l’on retrouve sur l’ordonnance comme sur la boîte des médicaments génériques. Le pharmacien pourra ensuite proposer aux patients le médicament d’origine grâce à cette DCI.
Taux de prescription dans le répertoire des génériques
Le taux de prescription dans le répertoire des génériques correspond aux médicaments (princeps et/ou génériques) prescrits appartenant au répertoire des génériques sur l’ensemble des médicaments prescrits en PHEV.
Taux de pénétration des génériques
Le taux de pénétration des génériques correspond au nombre de médicaments génériques délivrés sur l’ensemble des médicaments prescrits dans le répertoire des génériques (princeps ou génériques).
